نانوذرات و دارورسانی به مغز
نانوذرات و دارورسانی به مغز
مغز انسان حساسترین و پیچیدهترین عضو در بدن است که توسط سدی بسیار کارآمد به نام سد خونی- مغزی (Blood Brain Barrier, BBB) محافظت میشود. این سد به خوبی قابلیت دفاع از سلولهای مغزی را در برابر محتویات خون و ترکیبات سمی موجود در آن دارد. اما همین سد ورود داروها به مغز را نیز محدود مینماید. برای دسترسی داروها به بافت مغز میتوان از تزریقات داخل نخاعی استفاده کرد که البته محدود به نواحی خاصی از مغز است و روشی تهاجمی محسوب میشود. روشهای غیر تهاجمی دسترسی به مغز بهترین راه دارورسانی به آن هستند. با توجه به سطح تماس زیاد خون با مغز (حدود 20 متر مربع) انتظار میرود داروها از این راه قابلیت جذب داشته باشند. در این میان نانوداروها برای انتقال داروهایی که نفوذ کمی به سلولهای مغزی دارند استفاده میشوند. با توجه به اندازهی کوچک این ذرات، آنها آزادانه در عروق خونی حرکت میکنند و به بافت مغزی وارد میشوند.
1- سد خونی- مغزی طبیعی
سد خونی- مغزی در پوشش اندوتلیوم (endothelium) عروق مغزی و در
تماس نزدیک با سلولهای پریسایت (pericyte)، آستروسیت (actrocyte)، نورونها و سلولهای گلیال (glial cells) قرار دارد (شکل 1) [1].
 شکل 1- ساختار سد خونی- مغزی [2]
شکل 1- ساختار سد خونی- مغزی [2]
این سد دارای ویژگیهای زیر است:
1- اتصالات محکم (tight junctions) که سلولهای پوششی
را به هم متصل نموده و انتشار غیر فعال (passive diffusion) به مغز را محدود به ترکیبات ریز چربیدوست با وزن مولکولی بین 400
تا 500 دالتون و Log P بین 1 تا 3 کرده است
[1]. Partition coefficien (ضریب توزیع) یا
همان Log P، نسبت غلظت یک ماده در
فاز آلی (معمولا اکتانول) نسبت به فاز آبی است که هر چه ترکیب چربی دوست تر، عدد
ضریب توزیع بزرگتر است.
2- یک سیستم پیچیده از ناقلهای پروتئینی که باعث ورود انتخابی ذرات محلول آبدوست
و درشتمولکولهای لازم برای هموستاز (hemostasis) سیستم عصبی مرکزی
میشود. بعلاوه قابلیت بیرون راندن ترکیبات سمی و متابولیتها را نیز دارد.
3- سدی متابولیسمی با قابلیت تغییر مولکولها و سمزدایی از مغز
4- عمل پینوسیتوز (pinocytosis) محدود [1]
عمل اصلی سلولهای پریسایت سنتز و آزادسازی ترکیبات مختلف در غشای پایه و کنترل
جریان خون است. آستروسیتها نیز مسئول هموستاز و تنظیم یونی مغز هستند [3].
مقاومت الکتریکی بالا در پوشش عروق مغز باعث محدود شدن نفوذ ترکیبات یونی میگردد.
سد خونی- مغزی مسئول عدم عبور 98% از مولکولهای کوچک و 100% مولکولهای بزرگ به
داخل مغز است. البته در حالتهای آسیب به مغز مانند ضربه به سر، سکته، بیماریهای میکروبی
و متابولیسمی، میزان این نفوذپذیری افزایش مییابد [1].
2- مکانیسمهای انتقال ترکیبات از سد خونی- مغزی
همانطور که در قسمت قبل بیان شد، سد خونی- مغزی به درصد محدودی از مواد اجازهی
عبور میدهد. این ترکیبات برای عبور از سلولهای مغزی از روشهای مختلفی استفاده
میکنند که در شکل 2 بهطور شماتیک به آنها اشاره شده است.
شکل 2- انواع روشهای عبور مواد از سد خونی- مغزی [4]. P-گلیکوپروتئینها دستهای از پمپها هستند که با خروج داروها از سلول مورد نظر باعث عدم دسترسی دارو به هدف میشوند.
3- راههای پیشنهادی برای رساندن دارو به مغز
بهطور کلی راههای دارورسانی به مغز را میتوان به دو دستهی تهاجمی (invasive) و غیر تهاجمی (noninvasive) تقسیم بندی کرد
[3].
1- راههای تهاجمی
• تخریب سد خونی- مغزیتخریب اسمتیک و باز کردن اتصالات محکم بین سلولی
2- راههای غیر تهاجمی
- استفاده از پیشداروها (prodrugs)
- حاملهای کلوئیدی (مانند نانوذرات)
باز کردن اتصالات محکم با کمک فشار اسمزی میتواند علاوه بر ورود
داروها، موجب ورود سموم و سایر مواد ناخواسته به مغز گردد. بههمین علت تحقیقات
بیشتر به سمت روشهای غیر تهاجمی پیش رفته است.
بهطور کلی، با افزایش خاصیت چربیدوستی مولکولهای دارویی کوچک، امکان انتقال
آنها به داخل مغز افزایش مییابد. پیشداروها نیز غالبا با همین ویژگی تولید
میشوند. البته افزایش چربیدوستی همهی داروها موثر و امکانپذیر نیست زیرا گاه
با این تغییرات داروها اثر درمانی خود را از دست میدهند یا فعالیت پروتئینهای
بیرونکننده مانند P-گلیکوپروتئین بر آنها افزایش
مییابد. با افزایش چربیدوستی، متابولیسم و میزان پراکندگی دارو در بدن نیز
افزایش مییابد که این امر خود موجب افزایش دوز داروی مصرفی و در نتیجه افزایش
عوارض جانبی میشود. بهعلاوه همهی پیشداروها در مغز توانایی شکستن ندارند. در
چنین مواردی میتوان از نانوذرات برای دارورسانی استفاده نمود [1]. ویژگیهای
نانوذرات که موجب انتخاب آنها برای دارورسانی به مغز میشود، بهطور خلاصه در جدول
1 بیان شده است.
همانطور که قبلا اشاره شد، مولکولهای بزرگ مانند پپتیدها، پروتئینها یا ژنها،
توانایی عبور از سد خونی- مغزی را ندارند. به علاوه، این ترکیبات پایداری کمی در
محیط زیستی داشته، سریعا متابولیزه شده و در داخل مغز انتشار نمی یابند. در نتیجه
برای مشاهده ی اثر درمانی این مولکولها نیز نیازمند حرکت به سمت نانوذرات هستیم
[1].
جدول 1- ویژگیهای ایدهآل نانوذرات برای دارورسانی به مغز [1]
4- انواع نانوذرات برای دارورسانی به مغز
4-1- نانوذرات لیپیدی جامد (Solid Lipid Nanoparticles, SLNs)این حاملهای کلوئیدی از لیپیدهای زیستسازگار یا زیست تخریبپذیر ساخته شدهاند که در دمای بدن جامد بوده و بین 100 تا 1000 نانومتر هستند. لیپیدها شامل تریگلیسیریدهای خالص شده یا مخلوط گلیسیریدها و مومها میباشند [3].
یکی از مشکلات استفاده از این نوع نانوذرات، امکان پاک شدن سریع آنها از جریان خون توسط سیستم رتیکولواندوتلیال (reticuloendothelial system) و ماکروفاژها است [5]. برای غلبه بر این مشکل میتوان از راههای زیر استفاده نمود:
اگر اندازه ی نانوذرات لیپیدی جامد حدود 120 تا 200 نانومتر باشد، عمدتا قابلیت فرار از سیستمهای پاک کننده را دارند [3]. همچنین با اتصال ترکیبات آبدوست مانند پلیمر پلی اتیلن گلیکول (PEG) و یا اتصال آنتی بادیها بر روی این ساختارها میتوان علاوه بر محافظت از نانوذرات در مقابل سیستمهای پاککنندهی خونی، آنها را برای هدف درمانی اختصاصی به سلولهای مغزی آماده نمود [5].
تهیهی نانوذرات لیپیدی جامد از نظر اقتصادی و صنعتی نیز مقرون به صرفه است. روشهای تهیه ی این نانوذرات در سایر مقالات ذکر شده است و در اینجا فقط به طور شماتیک به سنتز آنها اشاره میشود.
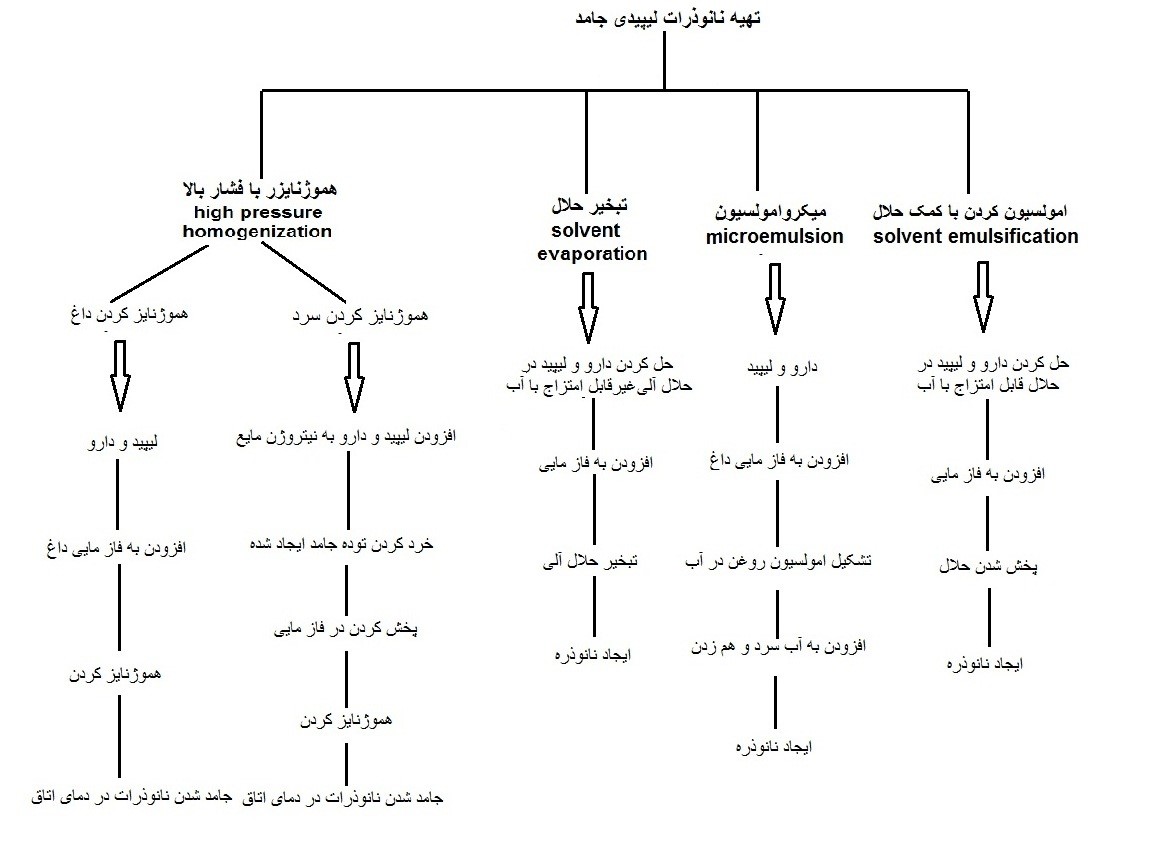
شکل 3- روشهای مختلف سنتز نانوذرات لیپیدی جامد [3]
با توجه به روشهای ساخت، نانوذرات لیپیدی جامد اشکال مختلفی مانند مدل دارو در
مرکز، دارو در پوشش و محلول جامد که دارو و لیپید به صورت یکدست و پراکنده در
نانوذره قرار میگیرند، خواهند داشت (شکل 4).

شکل 4- انواع اشکال قرارگیری دارو در داخل نانوذرات لیپیدی جامد [3]
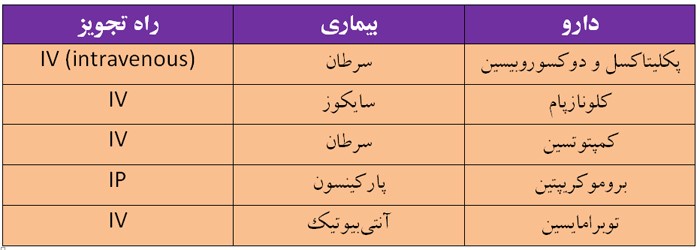
جدول 2 برخی از تحقیقاتی را که تاکنون پیرامون دارورسانی نانوذرات لیپیدی جامد به
مغز صورت گرفته است، نشان می دهد:
جدول 2- داروهای استفاده شده در تحقیقات برای دارورسانی به مغز با کمک نانوذرات لیپیدی جامد [3]
4-2- نانوذرات پلیمری
این نانوذرات در مقایسه با سایر نانوذرات کلوئیدی در مواجهه با مایعات بدن پایداری
بیشتری دارند. به علاوه پلیمر آنها میتواند با تغییراتی، خاصیت آزادسازی کنترل
شده نیز داشته باشد. نانوذرات میتوانند از پلیمرهای آماده یا از پلیمریزه کردن
مونومرها تشکیل شوند و نانوکپسول یا نانوسفر ایجاد نمایند [4]. یک نمونه موفق
نانوذرات استفاده شده در فاز درونتن برای دارورسانی به مغز پلیمر سریع تخریب
شونده ی پلی بوتیل سیانوآکریلات است. بر سطح این نانوذرات میتوان تغییراتی ایجاد
کرد و با اتصال لیگاند یا پلیمر پلی اتیلن گلیکول موجب بهبود دارورسانی به سلولها
و هدفمندسازی آن شد [5].
1-2-4-تهیه نانوذرات پلیمری
روشهای متعددی برای تهیه ی نانوذرات وجود دارد که در ادامه به طور خلاصه به
آنها اشاره خواهد شد.
• پلیمریزه کردن امولسیون (Emulsion polymerization)
این روش یکی از سریعترین و رایج ترین روشهای تولید نانوذرات پلیمری است. برای
این کار مونومر به فاز پیوسته افزوده شده و با سرعت ثابتی به هم زده میشود.
پلیمریزه کردن میتواند با استفاده از رادیکالهای آزاد یا تشکیل یون آغاز گردد.
ابتدا مونومر با آغازکننده (initiator) واکنش میدهد.
انرژی شروع واکنش نیز میتواند از نور فرابنفش، یونهای هیدروکسیل یا تابش با
انرژی زیاد تامین شود. سپس این سیستم مونومر- آغازگر با سایر مونومرها واکنش داده
و تشکیل زنجیره پیش میرود. در پایان هم از راه سانترفیوژ، مونومرهای واکنش نداده
را جدا میکنند. این پلیمرها میسل و قطره هایی ایجاد میکنند که از حدود 100 تا
107 مولکول پلیمری تشکیل شدهاند. پلیمرهای ایجاد شده توسط این فرآیند، قابلیت
بارگیری دارو را چه بر سطح و چه در درون خود دارند [5و4].
این فرآیند دارای مزیتهای زیر است: سریع بودن، عدم نیاز به پایدارکننده و قابلیت
صنعتی شدن. در ضمن این روش در فاز آلی هم قابل انجام است که برای تهیه نانوذرات از
پلیمر پلی آلکیل سیانوآکریلات استفاده میشود. در مقابل به علت نیاز به کاربرد نور
فرابنفش، تابش یا آغازکننده، استفاده از پروتئینها و پپتیدها در این روش
امکانپذیر نیست [5].
• پلیمریزه کردن بین سطحی (Interfacial polymerization)
برای این کار مونومرها باید در سطح مشترک بین دو فاز غیر قابل امتزاج (یک فاز آلی
و یک فاز آبی که در حال هموژن شدن یا به هم خوردن شدید هستند) قرار گیرند. اولین
عیب این روش استفاده از نیروهای برشی شدید است. در نتیجه از پروتئینها یا پپتیدها
نمیتوان استفاده نمود. در حین کار، مونومر خودبخود به پلیمر تبدیل شده و نانوکپسولی
را که داخل آن فاز آلی و پوشش آن پلیمر است تشکیل میدهد. مزیت این روش آن است که
دارو در داخل کپسول و نه در سطح قرار میگیرد. در نتیجه از اثر آنزیمها بر دارو
که ممکن است باعث تخریب آن پیش از رسیدن به سد خونی- مغزی شوند، جلوگیری به عمل
میآید [5و4].
• تبخیر حلال (Solvent evaporation)
این روش برای ساخت ذرات کوچکتر از 1 میکرومتر و بزرگتر از آن مورد استفاده قرار
میگیرد. در این روش پلیمر از پیش ساخته و دارو در یک حلال آلی قابل تبخیر اما غیر
قابل امتزاج با آب حل میشوند. سپس این فاز آلی به فاز مایی در حال چرخیدن افزوده
می گردد. فاز آلی با کمک حرارت یا کاهش فشار خارج شده و نانوذراتی که شامل داروی
پخش شده در ماتریکس پلیمری هستند، رسوب میکنند. سپس ذرات با کمک فیلتراسیون یا
سانتریفیوژ خالصسازی میشوند [6].
• ته نشینی حلال (Solvent deposition)
در این فرآیند پلیمر و لیپید در حلال آلی قابل تبخیر حل شده و سپس محلول حاصل به
فاز آبی که در حال چرخش با سرعت متوسط است افزوده میشود. در نهایت،
نانوکپسولهایی با مرکزی روغنی و پوششی پلیمری بدست میآیند. با کاهش فشار میتوان
حلال آلی را نیز خارج نمود [6].
• دناتوره کردن (Denaturation)
نانوذرات میتوانند با دناتوره کردن درشتمولکولهای طبیعی مثل آلبومین و ژلاتین
در یک امولسیون روغنی بدست آیند. برای این کار درشت مولکول در یک فاز آلی توسط
هموژنایز کردن محصور میگردد و سپس به آرامی به فاز مایی افزوده میشود. در نهایت
ذرات با استفاده از آلدهید، تخریب از طریق گرما یا سرد کردن زیر نقطه تشکیل ژل،
به شکل جامد در میآیند. بسته به سرعت چرخش، قدرت هموژنایزر و قدرت برش آن اندازه
ذرات متفاوت خواهد بود [5].
جدول 3 برخی از تحقیقات انجام گرفته روی نانوذرات پلیمری برای دارورسانی به مغز را
نشان میدهد.
جدول 3- انواع داروها و پلیمرهای بهکار رفته برای دارورسانی به مغز توسط نانوذرات پلیمری و نتایج آنها [5]
5- روشهای غالب عبور نانوذرات از سد خونی- مغزی
• انتقال با کمک جذب (Absorptive-mediated endocytosis, AME)
این انتقال با ایجاد برهمکنش الکترواستاتیک بین ذره با بار مثبت و غشاهای پلاسمایی با بار منفی آغاز میشود. این مسیر مختص مغز نیست و در کبد، کلیه و یا ریه هم وجود دارد. در یک تحقیق با استفاده از پلیمر پلی لاکتاید که به پلیمر PEG اتصال یافته بود، نانوذرات تهیه شدند و نتایج، انتقال نانوذرات ایجادی با کمک جذب را نشان داد (هدف از حضور PEG، بهبود عملکرد فرمولاسیون ایجادی و افزایش ماندگاری نانوذرات است) [1].
• انتقال با کمک گیرنده (Receptor-mediated transcytosis)
برای این نوع انتقال، باید بر روی نانوذره لیگاند خاصی قرار داده شود تا با اتصال به یک گیرندهی خاص امکان ورود به سلولهای مغزی را داشته باشد [5و4].
• انتشار غیر فعال
با توجه به خاصیت لیپیدی نانوذرات لیپیدی جامد، احتمال عبور آنها از طریق انتشار غیر فعال وجود دارد. در چند تحقیق میزان دارو در سلولهای مغزی نیز اندازهگیری شد که نشانگر افزایش ورود دارو به سلول در هنگام حضور لیپید در سطح نانوذره در مقایسه با حالتی که لیپید حضور نداشت، بود [5].
6- پایداری
در تعدادی از تحقیقات که بر روی پایداری نانوذرات ایجاد شده در محیطهای مختلف مانند محیط اسیدی، سرم انسانی و آب صورت پذیرفته است، نانوذرات پایداری مناسبی داشته اند. مثلا نانوذرات در محیط اسیدی تا چندین ماه بدون رسوب باقی میمانند یا سوسپانسیون آنها در سرم انسانی تا 8 روز پایدار است. در نتیجه این ساختارها توانایی ایجاد فرمولاسیون دارویی چه به صورت محلول و چه به صورت پودر لیوفیلیزه را دارند [6].بحث و نتیجه گیری
برای دارورسانی به مغز باید بر سد خونی- مغزی غلبه نمود. فناوری نانوذرات میتواند روشی ارزشمند برای انتقال داروها از این سد باشد زیرا نانوذرات اندازهای کوچک در حدود 200 نانومتر دارند و قابل پخش شدن در محیط مایی هستند. بسته به روش ساخت میتوان دارو را در داخل نانوذره یا در سطح آن قرار داد. به علاوه نانوذرات پایداری کافی برای ایجاد فرمولاسیونهای دارویی را دارند. در نتیجه مبحث دارورسانی به مغز از راه نانوذرات میتواند یکی از شاخه های قابل پیشرفت برای درمان بیماریها با کمک فناوری نانو باشد.منابـــــع :
· [1] Thassu, D., Deleers, M., Pathak, Y. ‟Nanoparticulate Drug Delivery Systems”, USA: Informa Healthcare Inc, (2007).
· [2] Blasi, P., Giovagnoli, S., Schoubben, A., Ricci, M., Rossi, C. ‟Solid Lipid Nanoparticles for Targeted Brain Drug Delivery”, Advanced Drug Delivery Reviews, Vol. 59, pp. 454-477, (2007).
· [3] Humtsoe, L. C. ‟Brain Delivery by Solid Lipid Nanoparticles for CNS Drugs”, International Journal of Pharmaceutical Research and Development, Vol. 3, pp. 206-216, (2011).
· [4] Roney, C., Kulkarni, P., Arora, V., Antich, P., Bonte, F., Wu, A. ‟Targeted Nanoparticles for Drug Delivery through the Blood-Brain Barrier for Alzheimer’s Disease”, Journal of Controlled Release, Vol. 108, pp. 193-214, (2005).
· [5] Lockman, P. R., Mumper, R. J., Khan, M. A., Allen, D. D. ‟Nanoparticle Technology for Drug Delivery Across the Blood-Brain Barrier”, Drug Development and Industrial Pharmacy, Vol. 28, pp. 1-12, (2002).
· [6] Nalwa, H. S. ‟Encyclopedia of Nanoscience and Nanotechnology”, Vol. 7, pp. 91-104, (2004).





 آرش
آرش